La electroquímica es una rama de la química que estudia las reacciones químicas que involucran transferencia de electrones. Uno de los aspectos más interesantes de la electroquímica es su aplicación en las baterías, dispositivos que almacenan energía electroquímica y que son fundamentales en nuestra vida cotidiana.

¿Qué es una batería?
Una batería es un dispositivo que convierte la energía química en energía eléctrica a través de reacciones electroquímicas. Está compuesta por uno o varios compartimentos llamados celdas, que contienen dos electrodos sumergidos en un electrolito. Los electrodos están hechos de diferentes materiales, como metales o compuestos químicos, y el electrolito puede ser una solución acuosa o un gel.
La batería tiene un polo positivo, llamado ánodo, y un polo negativo, llamado cátodo. Durante la descarga de la batería, se produce una reacción química en el ánodo que libera electrones, los cuales fluyen a través de un circuito externo hacia el cátodo, generando corriente eléctrica. Al mismo tiempo, ocurre una reacción en el cátodo que permite la entrada de electrones y la reducción de un compuesto químico.
Reacciones electroquímicas en una batería
Las reacciones electroquímicas que ocurren en una batería se pueden dividir en dos etapas: la oxidación en el ánodo y la reducción en el cátodo. Estas reacciones están impulsadas por la diferencia de potencial eléctrico entre los electrodos, que se conoce como voltaje de la batería.
En el ánodo, se produce una reacción de oxidación donde el material del electrodo cede electrones al electrolito. Por ejemplo, en una batería de plomo-ácido, el ánodo está compuesto por plomo metálico que se oxida y forma iones de plomo y electrones.
En el cátodo, se produce una reacción de reducción donde el compuesto químico del electrodo acepta los electrones provenientes del ánodo. Siguiendo con el ejemplo de la batería de plomo-ácido, el cátodo está compuesto por dióxido de plomo (PbO2) que se reduce a plomo sólido y iones de oxígeno.
La diferencia de potencial entre el ánodo y el cátodo impulsa el flujo de electrones a través del circuito externo, generando corriente eléctrica. A medida que la reacción química avanza, el material del ánodo se consume y el material del cátodo se reduce, lo que eventualmente agota la capacidad de la batería.
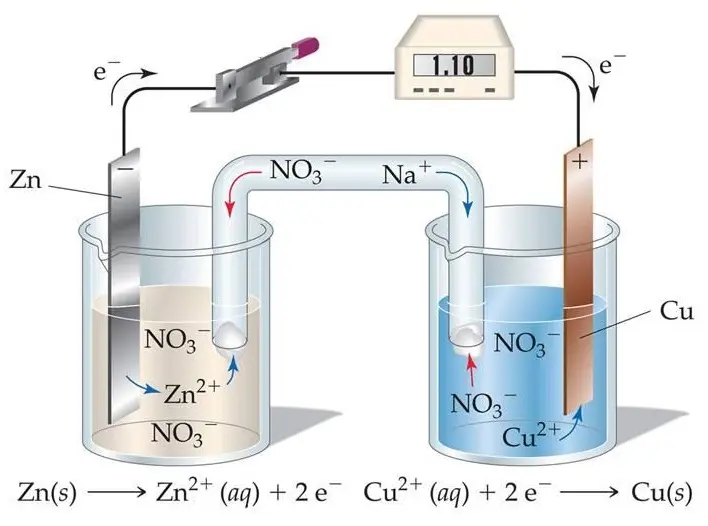
Tipos de baterías electroquímicas
Existen diferentes tipos de baterías electroquímicas, cada una con sus propias características y aplicaciones. Algunos ejemplos comunes son:
- Baterías de plomo-ácido: Son utilizadas en vehículos, sistemas de respaldo de energía y aplicaciones industriales. Tienen un voltaje de 2V por celda y son recargables.
- Baterías de ion-litio: Son ampliamente utilizadas en dispositivos electrónicos portátiles, como teléfonos móviles y computadoras. Tienen un voltaje de 7V por celda y son recargables.
- Baterías de níquel-cadmio: Fueron muy populares en el pasado, pero su uso ha disminuido debido a su alto contenido de cadmio, un metal tóxico. Tienen un voltaje de 2V por celda y son recargables.
Aplicaciones de la electroquímica en las baterías
La electroquímica es fundamental en el funcionamiento de las baterías, ya que permite el almacenamiento y la liberación controlada de energía. Esto ha llevado al desarrollo de aplicaciones muy diversas en nuestra vida cotidiana, como:
- Vehículos eléctricos: Las baterías de ion-litio han permitido el avance de los vehículos eléctricos, ofreciendo una alternativa más sostenible a los motores de combustión interna.
- Dispositivos electrónicos portátiles: Gracias a las baterías recargables de ion-litio, podemos utilizar nuestros teléfonos móviles, tabletas y computadoras sin depender de una fuente de energía externa.
- Energía renovable: Las baterías son fundamentales en sistemas de almacenamiento de energía renovable, como paneles solares y turbinas eólicas, permitiendo el uso de energía limpia incluso cuando no hay luz solar o viento.
Consultas habituales sobre la electroquímica de las baterías
¿Qué es el voltaje de una batería?
El voltaje de una batería es la diferencia de potencial eléctrico entre el ánodo y el cátodo. Es una medida de la fuerza con la que los electrones son impulsados a través del circuito externo.
¿Las baterías son recargables?
Algunas baterías son recargables, lo que significa que pueden ser recargadas mediante la aplicación de una corriente eléctrica. Estas baterías permiten el uso repetido y la recarga de energía electroquímica.
¿Cuánto tiempo dura la vida útil de una batería?
La vida útil de una batería depende de varios factores, como el tipo de batería, la aplicación y las condiciones de uso. En general, las baterías tienen una vida útil limitada y eventualmente deben ser reemplazadas.
La electroquímica es una ciencia maravilloso que juega un papel crucial en el funcionamiento de las baterías. Gracias a las reacciones electroquímicas, las baterías pueden almacenar y liberar energía, permitiendo su uso en una amplia gama de aplicaciones. Desde vehículos eléctricos hasta dispositivos electrónicos portátiles, las baterías son fundamentales en nuestra vida diaria. A medida que avanza la investigación en electroquímica, es probable que veamos avances aún más emocionantes en el campo de las baterías y el almacenamiento de energía.
¿Quieres encontrar más artículos similares a La electroquímica y las baterías: ciencia y aplicaciones? Te invitamos a explorar la sección de Baterías en Baterías Rincón para descubrir más contenido relacionado.

